微生物的运动
Actin and its interacting proteins form an indispensable network in cells; a dynamic filament system that is crucial for locomotion, 细胞分裂, 形状, 以及各种形式的细胞内运动. 控制特定位点的肌动蛋白丝的组装和拆卸对于将这些活动引导到细胞中的适当位置至关重要. 微生物可以触发肌动蛋白细胞骨架的重排,典型的是肠 单核细胞增多性李斯特氏菌. 进入活细胞后, 这些生物利用肌动蛋白网络在宿主细胞质中移动或进入并感染邻近细胞. 其他微生物如 志贺氏杆菌, 立克次氏体 牛痘病毒也会分享 李斯特菌的作案手法i.
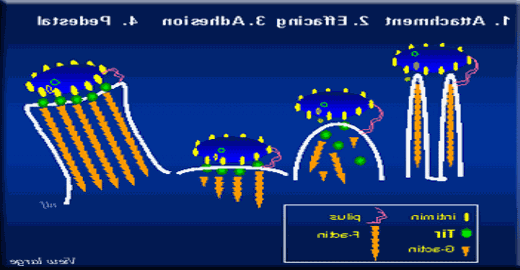
革兰氏阴性肠 大肠杆菌 也重塑肌动蛋白细胞骨架. 致肠病的 E. 杆菌 (EPEC)和肠出血 E. 杆菌 肠出血性大肠杆菌附着在肠细胞表面,引起微绒毛的丢失或消失, 导致腹泻. Colonization of intestinal cells by EPEC and EHEC is characterized by: 1) extracellular surface attachment; 2) microvilli effacement; 3) microorganism adhesion and 4) pedestal formation. 许多肌动蛋白结合蛋白, alpha-actinin, Arp2/3, ezrin, 美丽的, 绒毛蛋白和黄蜂蛋白集中在EPEC附着物下面. 生物体在肌动蛋白丝的基座上休息,并在宿主细胞表面滑行,同时附着在细胞外膜上. 我们知道运动需要肌动蛋白聚合, 但我们不了解肌动蛋白动力学和其他产生运动的蛋白质.

作为感染过程的一部分, EPEC编码的蛋白Tir(反式内膜素受体)通过III型分泌系统分泌并注入宿主真核细胞膜. Tir是一种具有两个预测跨膜区域的蛋白质,类似于发夹结构. 在结构上, the protein can be divided into three distinct domains: a predicted alph-helix N-terminal domain of 233 amino acids; a second centralized domain of 106 amino acids (includes one tyrosine) and a third predicted alpha-helix domain of 165 amino acids (contains three tyrosines). 这三个蛋白结构域的膜位置已经很好地确定,第一和第三结构域暴露于细胞质, 第二个区域是细胞外到被感染的细胞.
Tir的氨基酸序列分析显示其与其他已知蛋白几乎没有同源性. 我们对Tir和宿主细胞蛋白之间的分子相互作用特别感兴趣. 持续了解宿主细胞/病原体相互作用的分子机制对我们诊断和治疗传染病至关重要.
